氮杂环轴手性化合物在不对称催化、药物化学以及材料化学等领域有着诸多应用,近年来,关于此类化合物的合成方法被广泛的开发(图1a)。然而,基于喹嗪酮骨架的轴手性化合物的高效构建目前尚未见报道。近期,化学与化工学院基于前期研究基础(JACS, 2021, 143, 10686; CRPS, 2021, 2, 100594; CS, 2020, 11, 10119; OL.2019, 21, 724),通过不对称去芳构化策略,使用吡啶单元作为亲核试剂,成功实现了该类轴手性化合物的构建。
通常情况下,吡啶的不对称去芳构化主要通过两种方式实现:(1)不对称还原法,(2)不对称加成法。针对不对称加成法,反应过程需将吡啶氮原子预活化,使得吡啶单元由亲核试剂转变成亲电试剂,然后实现吡啶环的不对称去芳构化(图1b),直接利用吡啶单元作为亲核试剂,进而实现手性分子构建的研究相对较少。在这一类型反应中,反应底物多局限于2-氧代吡啶类化合物(图1c 和 1d),利用未活化吡啶的亲核性实现不对称去芳构化的反应研究较为罕见。基于此研究背景,作者通过金属Cu催化环异构化策略,首次利用未活化吡啶的亲核性,实现芳基喹嗪酮类轴手性化合物的构建(图1e),开发了此类化合物构建的新型方法学。
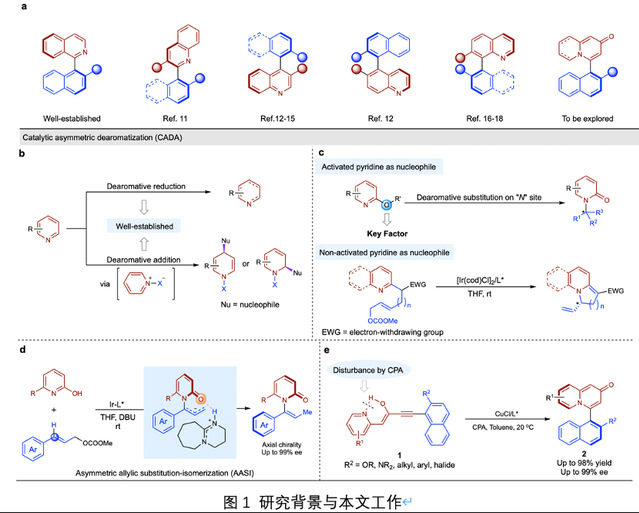
通过条件探索发现,反应过程中,联萘酚磷酸添加剂可以显著提高反应的活性,使得反应体系具有良好的底物适用范围。控制实验表明,联萘酚磷酸不参与反应过程中的手性诱导,产物的对映选择性仅由与铜催化剂络合的手性配体控制。核磁共振证实底物在反应中以烯醇式和酮式两种形式存在,联萘酚磷酸的加入可以改变底物中烯醇式和酮式比例,原料中的酮与手性磷酸产生的氢键作用,在金属铜活化三键过程中,会增加炔酮的亲电性,促进吡啶对炔酮的进攻,实现轴手性化合物的高效构建。非线性自由能分析显示,反应原料中的萘环2号位取代基的电子效应和空间位阻同时影响产物的对映选择性。
综上,化学与化工学院课题组首次实现了吡啶的亲核性不对称去芳构化构建喹嗪酮环轴手性化合物,并通过核磁动态监测,非线性自由能分析等手段验证反应机理。所得的手性化合物通过简单转化可得到包括手性硫脲催化剂在内的多种杂环化合物,具有较大的理论和实际应用价值。相关成果于近期发表在Nature Communications上,论文链接https://www.nature.com/articles/s41467-022-27989-3。
化学与化工学院博士研究生闵小龙、张秀莲分别为本文的第一作者和第二作者,本文通讯作者分别为何英教授和易文斌教授,该研究工作主要由江苏省自然科学金(BK20180447)资助。




